알칼로이드 목차 명칭 역사 분류 성질 자연계의 분포 같이 보기 각주 참고 문헌 둘러보기 메뉴IUPAC. Compendium of Chemical Terminology10.1351/goldbookChemical Encyclopedia: alkaloidsTSB: Coniine과거 내용 찾기912173010.1039/NP9971400075Chemical Encyclopedia: Tropan alkaloidsChemical Encyclopedia: Pyrrolizidine alkaloids1586143210.1002/cbic.2004003271675562710.1002/cbic.2006000661734675910.1016/j.phytochem.2007.01.010Chemical Encyclopedia: Quinolizidine alkaloids10.1039/b208137gChemical Encyclopedia: pyridine alkaloidsChemical Encyclopedia: isoquinoline alkaloids928183910.1039/NP9971400387“Amaryllidaceae, muscarine, imidazole, oxazole, thiazole and peptide alkaloids, and other miscellaneous alkaloids”1071489910.1039/a809403iChemical Encyclopedia: Quinazoline alkaloids“The biosynthesis of plant alkaloids and nitrogenous microbial metabolites”10.1039/a705734bChemical Encyclopedia: Quinoline alkaloids“PlantCyc Pathway: ephedrine biosynthesis”원본 문서Chemical Encyclopedia: colchicine alkaloidsSpermine BiosynthesisChemical Encyclopedia: Terpenes“Diterpenoid and steroidal alkaloids”914941010.1039/np9971400191Cancer Drug Behind Cyclops Birth?“TSB: Nicotine”원본 문서ehsh8500359800560348
5-MeO-DMT알스토닌다이메틸트립타민하르말라 알칼로이트프실로신실로시빈레세르핀세로토닌트립타민요힘빈카페인테오브로민테오필린니코틴코데인모르핀아코니틴솔라닌
알칼로이드
염기질소화합물탄소수소질소황염소브로민인천연물이차대사산물박테리아균류식물동물산염기 추출생체독성약리학의약품흥분제코카인카페인니코틴진통제모르핀퀴닌물질대사아미노산펩타이드단백질뉴클레오타이드핵산아민메스칼린세로토닌도파민아민라틴어어근그리스어접미사벨라돈나풀아트로핀마전스트리키니네빙카속메소포타미아호메로스오디세이아마황양귀비코카나무아코니틴튜보크라린프리드리히 제르튀르너모르피우스모르핀피에르 펠레티에조셉 카방투퀴닌스트리키니네크산틴아트로핀카페인코닌니코틴콜히친스파르테인코카인코닌아세트알데히드나트륨분광학크로마토그래피인돌이소퀴놀린피리딘니코틴니코틴아미드피롤리딘갈란타민니코틴코닌베르베린상귀나린생산관다발식물사리풀스트리키니네인도사목기나나무환각버섯속실로시빈균류부포테닌아드레날린세로토닌아민
알칼로이드
둘러보기로 가기
검색하러 가기

최초로 분리된 단일 알칼로이드인 모르핀은 1804년 양귀비(Papaver somniferum)로 부터 분리되었다.[1]
알칼로이드(Alkaloid)는 자연적으로 존재하면서 대개 염기로 질소 원자를 가지는 화합물의 총칭이다. 대부분의 물질은 염기성이지만 일부 중성이나[2] 약한 산성을 띤 화합물까지 이에 포함되며,[3] 유사한 구조를 가진 인공 화합물까지도 알칼로이드라 일컫는다.[4]탄소와 수소, 질소는 기본이며 알칼로이드 분자는 또한 황과 드물게 염소, 브로민, 인까지 포함할 수도 있다.[5]
알칼로이드는 천연물이나 이차대사산물의 일종으로, 박테리아나 균류, 식물, 동물을 비롯한 다양한 생물군에서 얻을 수 있다. 많은 알칼로이드는 천연 그대로 뽑아낸 것을 산염기 추출을 통해 정제가 가능하다. 다른 생체에 대해 독성을 띠는 것이 많다. 흔히 약리학적 효과를 가지므로 의약품이나 마약 등으로, 신내림 의식 등에서도 사용된다. 대표적인 알칼로이드로 국소 마취제이자 흥분제인 코카인, 흥분제 카페인과 니코틴, 진통제 모르핀, 말라리아약으로 쓰는 퀴닌 등이 있다. 서로 다른 알칼로이드는 사람과 동물 물질대사의 서로 다른 부분에 작용하나 맛은 한결같이 쓰다.[6]
알칼로이드와 다른 함질소 자연 화합물의 경계는 그리 명확하지 않다.[7]아미노산 펩타이드, 단백질, 뉴클레오타이드, 핵산, 아민 같은 종류의 분자는 대개 알칼로이드라 부르지 않는다.[2] 외향 고리에 질소를 포함한 천연 분자(메스칼린, 세로토닌, 도파민, 등)도 대개 알칼로이드가 아니라 아민의 일종이라 보는데,[8] 관점에 따라서 알칼로이드 자체가 아민의 특수한 경우라고 볼 수도 있다.[9][10][11]
목차
1 명칭
2 역사
3 분류
4 성질
5 자연계의 분포
6 같이 보기
7 각주
8 참고 문헌
명칭

"알칼로이드"라는 개념을 처음 도입한 논문.
"알칼로이드"라는 이름은 1819년 독일의 약제사 Carl F.W. Meissner가 처음 사용한 것으로, 라틴어 어근 alkali 알칼리[*]("식물의 재"를 뜻하는 al qualja 알 쿠알자[*]에서 옴)와 그리스어 접미사 ειδοσ 에이도스[*]에서 파생되었다. 이 말은 사용되지 않다가 1880년대 O. Jacobsen이 Albert Ladenburg 화학용어사전에서 재발견한 후에야 널리 사용되기 시작했다.[12]
개개의 알칼로이드를 명명하는 단일한 규정은 없다.[13] 식물성 알칼로이드는 대개 속이나 종명에 접미사 "-ine"를 붙여 이름을 짓는다. 예로 벨라돈나풀에서 추출하는 아트로핀은 그 속명 아트로파에서, 마전의 씨에서 얻는 스트리키니네는 역시 그 속명 스트리크노스(마전속)에서 이름을 따온 것이다.[5] 한 식물에서 여러 종의 알칼로이드를 얻을 수 있을 때는 "-idine", "-anine", "-aline", "-inine" 등의 접미사가 붙는다. 이런 명명 방식으로, 빙카속(Vinca) 식물에서 뽑아낸 알칼로이드로서 어근 "vin"을 가진 알칼로이드는 86종이나 된다.[14]
역사
알칼로이드를 포함한 식물은 고대부터 치료용이나 기분 전환용으로 사용되었다. 메소포타미아에서는 기원전 2000년 즈음부터 약용으로 쓰는 식물이 알려져 있었다.[15]호메로스의 《오디세이아》에는 이집트 여왕이 헬렌에게 주었다는 선물, 즉 망각을 부르는 약이 나온다. 그 선물이란 것은 아편이 포함된 약으로 생각된다.[16] 화초에 대해 다룬 1~3세기 중국의 책은 또 마황과 양귀비의 의학적 효능에 대해 언급한다.[17]코카나무잎 역시 오래전부터 남아메리카 인디언이 사용해왔다.[18]
아코니틴, 튜보크라린 같이 독성 알칼로이드를 함유한 식물에서 뽑아낸 추출물은 고대부터 독화살의 화살축에 바르는데 쓰였다.
알칼로이드 연구는 19세기에 시작되었다. 1804년에 독일 화학자 프리드리히 제르튀르너(Friedrich Sertürner)는 아편초로부터 "잠의 근원"(라틴어: principium somniferum)을 분리해내어서, 그리스 신화의 꿈의 신 모르피우스에 대한 경의로 "모르피움"이라는 이름을 붙였다. 이 약이 지금의 모르핀이다.
프랑스의 연구자 피에르 펠레티에와 조셉 카방투는 퀴닌(1820)과 스트리키니네(1818)을 발견하면서 성장 초기 알칼로이드 화학에서 소중한 성과를 얻어냈다. 이후 크산틴(1817), 아트로핀(1819), 카페인(1820), 코닌(1827), 니코틴(1828), 콜히친(1833), 스파르테인(1851), 코카인(1860) 등 다른 알칼로이드가 속속 발견되었다.[19]
1886년에는 독일 화학자 라덴부르크(Albert Ladenburg)가 알칼로이드의 하나인 코닌을 인공적으로 합성하는 데 성공했다. 2-메틸피리딘을 아세트알데히드와 반응시키고 거기서 나온 2-프로페닐피리딘을 나트륨으로 분해함으로써 코닌을 얻었다.[20][21] 20세기 분광학과 크로마토그래피의 출현으로 알칼로이드 화학은 한층 가속되었고, 2008년까지 12,000개 이상의 알칼로이드가 식별되었다.
분류

두꺼비 독 부포테닌(Bufotenin). 인돌 핵이 있으며 아미노산 트립토판으로부터 살아있는 생물에서 합성된다.
알칼로이드는 대부분의 다른 자연 화합물에 비해 구조가 꽤나 다양하다는 것이 특성이며 알칼로이드를 분류하는 일관된 방법은 없다.[22] 역사적으로, 처음에는 알칼로이드를 특정한 종류의 나무라던가 하는 자연의 출처와 묶어서 분류했다. 알칼로이드의 분자 구조에 관해 아는 바가 없었으므로 나름대로는 타당한 방법이었지만 현재는 이런 방법을 쓰지 않는다.[5][23]
현대의 다른 분류들은 탄소 뼈대의 유사성이나(인돌알칼로이드, 이소퀴놀린알칼로이드, 피리딘알칼로이드 따위), 생물 발생상의 전구체(오르니틴계, 리신계, 타이로신계, 트립토판계 등)에 근거한다.[5] 그러나 분류의 경계선상에 있어 애매할 때는 절충이 필요한데,[22] 예로 니코틴은 니코틴아미드에서 만들어진 피리딘 조각과 오르니틴에서 만들어진 피롤리딘 부분을 포함하고 있고[24] 그러므로 두 분류 중 어디에 넣어도 이상하지 않다.[25]
알칼로이드는 대개 다음의 주분류군으로 나뉜다:[26]
- "진정알칼로이드(True alkaloids)" - 이종고리에 질소를 가지며 아미노산에서 비롯된 것.[27] 대표적인 예가 아트로핀, 니코틴, 모르핀 등이다. 또한 피페르딘 알칼로이드인 코민이나 코니세인은[28] 아미노산에서 비롯되지 않았음에도[29] 여기에 들어간다.
- "원시알칼로이드(Protoalkaloids)" - 질소를 가지며 역시 아미노산에서 비롯된 것.[27] 예로 메스칼린, 아드레날린, 에피드린 등이 있다.
- 폴리아민 알칼로이드 - 푸트레신계, 스페르미딘계, 스페르민계 따위
- 펩타이드 및 사이클로펩타이드 알칼로이드[30]
- 유사알칼로이드(Pseudalkaloids) - 아미노산에서 비롯되지 않았으나 알칼로이드와 유사한 화합물.[31]테르펜알칼로이드, 스테로이드알칼로이드를 비롯하여,[32]카페인이나 테오브로민, 테오필린 등이 속한 푸린알칼로이드가 있다.[33] 어떤 학자들은 에피드린이나 카티논을 유사알칼로이드로 분류하는데, 이것들은 아미노산인 페닐알라닌에서 비롯되긴 하지만 그 질소 원자를 아미노산이 아니라 아미노기 전이 과정에서 얻는다.[33][34]
어떤 알칼로이드의 경우 해당 주분류군의 특징이 되는 탄소 골격이 없다. 그래서 갈란타민이나 호모아포르핀 같은 것은 이소퀴놀린 조각을 포함하지 않음에도 일반적으로 이소퀴놀린알칼로이드에 넣는다.[35]
아래 표는 단합체 알칼로이드의 주요 종류를 나열한 것이다.
| 계통 | 분류군 | 주된 합성 과정 | 예 |
|---|---|---|---|
| 질소 이종고리가 있는 알칼로이드 (진정알칼로이드) | |||
필로리딘계[36] 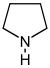 | 오르니틴 또는 아르기닌 → 푸트레신 → N-메틸푸트레신 → N-메틸-Δ1-피롤린[37] | 히그린(Hygrine), hygroline, 스타키드린(stachydrine)[36][38] | |
트로판계[39]  | 아트로핀 군 Substitution in positions 3, 6 or 7 | 오르니틴 또는 아르기닌 → 푸트레신 → N-메틸푸트레신 → N-메틸-Δ1-피롤린[37] | 아트로핀, 스코폴라민, 히오시아민[36][39][40] |
| 코카인 군 Substitution in positions 2 and 3 | 코카인, 엑고닌(ecgonine)[39][41] | ||
피롤리지딘계[42]  | 비에스테르(Non-esters) | 식물에서: 오르니틴 또는 아르기닌 → 푸트레신 → 호모스페르미딘(homospermidine) → retronecine[37] | Retronecine, heliotridine, laburnine[42][43] |
| 모노카르복실산 복합 에스테르 | Indicine, lindelophin, 사라신(sarracine)[42] | ||
| 거대환고리(Macrocyclic) 다이에스테르 | 플래티필린(Platyphylline), trichodesmine[42] | ||
| 1-아미노필로리지딘 (lolines) | 균류에서: L-프롤린(proline) + L-호모세린(homoserine) → N-(3-아미노-3-카르복시프로필)프롤린 → norloline[44][45] | 로린(Loline), N-formylloline, N-acetylloline[46] | |
피페리딘계[47]  | 리신 → 카다베린 → Δ1-피페리딘[48] | Sedamine, lobeline, anaferine, 피페린(piperine)[28][49] | |
옥탄산 → 코니신 → 코닌[29] | 코닌, 코니신[29] | ||
퀴놀리지딘계[50][51] | 루피닌 군 | 리신(Lysine) → 카다베린(cadaverine) → Δ1-피페리딘(piperideine)[52] | 루피닌(lupinine), nupharidin[50] |
시티신 군 | 시티신(Cytisine)[50] | ||
스파르테인 군 | 스파르테인(Sparteine), 루파닌(lupanine), anahygrine[50] | ||
마트린 군 | 마트린, 옥시마트린(oxymatrine), 알로마트린(allomatridine)[50][53][54] | ||
Ormosanine 군 | Ormosanine, piptantine[50][55] | ||
인돌리지딘계[56]  | 리신 → α-아미노아디핀산의 δ-세미알데히드 → 피페콜산 → 1 인돌리지딘[57] | 스와인소닌(Swainsonine), 카스타노스페르민(castanospermine)[58] | |
피리딘계[59][60] 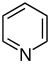 | 단순 피리딘계 물질 | 니코틴산 → 다이하이드로니코틴산(dihydronicotinic acid) → 1,2-다이하이드로피리딘(dihydropyridine)[61] | 트리고넬린, 리시닌, 아레콜린[59][62] |
| 다환비응축피리딘계(Polycyclic noncondensing-) | 니코틴, 노르니코틴, 아나바신, 아나타빈(anatabine)[59][62] | ||
| 다환응축피리딘계(Polycyclic condensed-) | 액티니딘(Actinidine), 겐치아닌(gentianine), pediculinine[63] | ||
세스퀴테르펜-피리딘계 | 니코틴산, 이소류신(isoleucine)[11] | 에보닌(Evonine), hippocrateine, triptonine[60][61] | |
이소퀴놀린계 및 관련 알칼로이드[64] 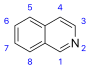 | 단순 이소퀴놀린계 물질[65] | 티로신(Tyrosine) 또는 페닐알라닌(phenylalanine) → 도파민(dopamine) 또는 티라민(tyramine) (for alkaloids Amarillis)[66][67] | 살솔린(Salsoline), lophocerine[64][65] |
| 1- 및 3-이소퀴놀린계 물질[68] | N-methylcoridaldine, noroxyhydrastinine[68] | ||
| 1- 및 4-페닐테트라하이드로이소퀴놀린계 물질[65] | Cryptostilin[65][69] | ||
| 5-나프틸-이소퀴놀린계 물질[70] | Ancistrocladine[70] | ||
| 1- 및 2-벤질-이소퀴놀린계 물질[71] | 파파베린(Papaverine), 라우다노신(laudanosine), sendaverine | ||
Cularine group[72] | Cularine, yagonine[72] | ||
Pavines and isopavines[73] | Argemonine, amurensin[73] | ||
| Benzopyrrocolines[74] | Cryptaustoline[65] | ||
| Protoberberines[65] | 베르베린, 카나딘, ophiocarpine, mecambridine, corydaline[75] | ||
| Phtalidisoquinolines[65] | 히드라스틴, 나르코틴, 노스카핀[76] | ||
| Spirobenzylisoquinolines[65] | Fumaricine[73] | ||
토근알칼로이드[77] | 에메틴(Emetine), 프로토에메틴(protoemetine), ipecoside[77] | ||
| Benzophenanthridines[65] | 산구이나린(Sanguinarine), oxynitidine, 코리놀록신(corynoloxine)[78] | ||
Aporphines[65] | 글라우신, 코리딘(coridine), 리리오데닌(liriodenine)[79] | ||
| Proaporphines[65] | Pronuciferine, glaziovine[65][74] | ||
| Homoaporphines[80] | Kreysiginine, multifloramine[80] | ||
| Homoproaporphines[80] | Bulbocodine[72] | ||
Morphines[81] | 모르핀, 코데인, 테바인, 시노메닌[82] | ||
| Homomorphines[83] | Kreysiginine, androcymbine[81] | ||
| Tropoloisoquinolines[65] | Imerubrine[65] | ||
| Azofluoranthenes[65] | Rufescine, imeluteine[84] | ||
아마릴리스알칼로이드[85] | 리코린, ambelline, 타제틴, 갈란타민, montanine[86] | ||
Erythrite alkaloids[69] | 에리소딘, 에리트로이딘[69] | ||
페난트렌계(Phenanthrene-)[65] | Atherosperminine[65][75] | ||
Protopins[65] | 프로토핀(Protopine), oxomuramine, corycavidine[78] | ||
| Aristolactam[65] | Doriflavin[65] | ||
옥사졸계[87] 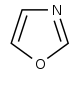 | 티로신 → 티라민[88] | Annuloline, halfordinol, texaline, texamine[89] | |
이소옥사졸계(Isoxazole-) 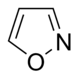 | 이보텐산(Ibotenic acid) → 무시몰(Muscimol) | 이보텐산, 무시몰 | |
티아졸계(Thiazole-)[90] 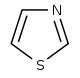 | 1-디옥시-D-크실룰로오스 5-인산염 (DOXP), 티로신, 시스테인[91] | Nostocyclamide, 티오스트렙톤(thiostreptone)[90][92] | |
퀴나졸린계(Quinazoline-)[93]  | 3,4-다이하이드로-4-퀴나졸린계 | 안트라닐산(Anthranilic acid) 또는 페닐알라닌 또는 오르니틴[94] | Febrifugine[95] |
| 1,4-다이하이드로-4-퀴나졸린계 | 글리코린(Glycorine), arborine, glycosminine[95] | ||
| 피롤리딘 및 피페르딘 퀴나졸린계 | 페가닌(peganine)[87] | ||
아크리딘계(Acridine-)[87] | 안트라닐산(Anthranilic acid)[96] | Rutacridone, 아크로니신(acronicine)[97][98] | |
퀴놀린계(Quinoline-)[99][100] 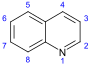 | Simple derivatives of quinoline derivatives of 2 - quinolones and 4-quinolone | 안트라닐산 → 3-카르복시퀴놀린[101] | Cusparine, echinopsine, evocarpine[100][102][103] |
| Tricyclic terpenoids | Flindersine[100][104] | ||
| Furanoquinoline계 | 딕탐닌, 파가린, 스킴미아닌(β-파가린)[100][105][106] | ||
Quinines | 트립토판 → 트립타민 → 스트릭토시딘(세콜로가닌과 함께) → korinanteal → cinhoninon[67][101] | 퀴닌, 퀴니딘, 신코닌, cinhonidine[104] | |
인돌계[82]  | 무(無)이소프렌 인돌알칼로이드 | ||
| 단순 인돌계 물질[107] | 트립토판 → 트립타민 또는 5-하이드록시트립토판[108] | 세로토닌, 실로시빈, 디메틸트립타민(DMT), 부포테닌[109][110] | |
| 단순 β-카르볼린계 물질[111] | 하르만, 하르민, 하르말린, 엘레아그닌[107] | ||
| 피롤로인돌알칼로이드(Pyrroloindole-)[112] | 피소스티그민(에세린), etheramine, physovenine, 엡타스티그민(eptastigmine)[112] | ||
| 준(準)테르페노이드 인돌알칼로이드 | |||
맥각알칼로이드(Ergot alkaloids)[82] | 트립토판 → chanoclavine → 아그로클라빈(agroclavine) → 엘리모클라빈(elimoclavine) → paspalic acid → 리세르그산(lysergic acid)[112] | 에르고타민(Ergotamine), 에르고바신(ergobasine), ergosine[113] | |
| 모노테르페노이드 인돌알칼로이드 | |||
Corynanthe type alkaloids[108] | 트립토판 → 트립타민 → 스트릭토시딘(세콜로가닌과 함께)[108] | 아즈말리신(Ajmalicine), 사르파긴(sarpagine), 보바신(vobasine), 아즈말린(ajmaline), 요힘빈(yohimbine), 레세르핀(reserpine), 미트라기닌(mitragynine),[114][115] group strychnine and (Strychnine brucine, aquamicine, vomicine[116]) | |
이보가형(Iboga-type) 알칼로이드[108] | Ibogamine, ibogaine, voacangine[108] | ||
아스피도스페르마형(Aspidosperma-type) 알칼로이드[108] | 빈카민, 빈코틴, 아스피도스페르민[117][118] | ||
이미다졸계(Imidazole-)[87] 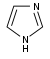 | 히스타딘(histidine)에서 직접[119] | 히스타민, 필로카르핀(pilocarpine), pilosine, stevensine[87][119] | |
푸린계[120] 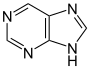 | 크산토신(푸린 생합성 중에 생김) → 7 메틸크산토신 → 7-메틸 크산틴 → 테오브로민 → 카페인[67] | 카페인, 테오브로민, 테오필린, 색시토신(saxitoxin)[121][122] | |
| 곁사슬에 질소를 가진 알칼로이드 (원시알칼로이드) | |||
β-페닐에틸아민계[74]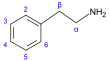 | 티롭신 또는 페닐알라닌 → 디옥시페닐알라닌 → 도파민 → 아드레날린, 메스칼린, 티로신 → 티라민 페닐알라닌 → 1-페닐프로판-1,2-디온 → 카티논(cathinone) → 에페드린 및 슈도에페드린(pseudoephedrine)[11][34][123] | 티라민, 에페드린, 슈도에페드린, 메스칼린, 카티논, 카테콜아민(catecholamines) (아드레날린, 노르아드레날린(noradrenaline), 도파민)[11][124] | |
콜히친알칼로이드[125]  | 티로신 또는 페닐알라닌 → 도파민 → autumnaline → 콜히친[126] | 콜히친, colchamine[125] | |
Muscarine[127]  | 글루탐산 → 3-케토글루탐산 → 무스카린 (피루브산과 같이)[128] | 무스카린, 알로무스카린(allomuscarine), 에피무스카린(epimuscarine), 에피알로무스카린(epiallomuscarine)[127] | |
Benzylamine[129]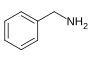 | 페닐알라닌 및 발린, 류신 또는 이소류신[130] | 캅사이신, 디하이드로캅사이신, 노르디하이드로캅사이신[129][131] | |
| 폴리아민 알칼로이드 | |||
푸트레신계[132] | 오르니틴 → 푸트레신 → 스페르미딘 → 스페르민[133] | Paucine[132] | |
스페르미딘계[132] | Lunarine, codonocarpine[132] | ||
스페르민계[132] | Verbascenine, aphelandrine[132] | ||
| 펩타이드(사이클로펩타이드) 알칼로이드 | |||
| Peptide alkaloids with a 13-membered cycle[30][134] | Numularine C type | From different amino acids[30] | Numularine C, numularine S[30] |
Ziziphin type | Ziziphin A, sativanine H[30] | ||
| Peptide alkaloids with a 14-membered cycle[30][134] | Frangulanine type | Frangulanine, scutianine J[134] | |
| Scutianine A type | Scutianine A[30] | ||
| Integerrine type | Integerrine, discarine D[134] | ||
| Amphibine F type | Amphibine F, spinanine A[30] | ||
| Amfibine B type | Amphibine B, lotusine C[30] | ||
| Peptide alkaloids with a 15-membered cycle[134] | Mucronine A type | Mucronine A[134][135] | |
| 유사알칼로이드 (테르펜 및 스테로이드) | |||
디테르펜(Diterpenes)[135] | Licoctonine type | 메발론산(Mevalonic acid) → izopentenilpyrophosfate → geranyl pyrophosphate[136][137] | 아코니틴(Aconitine), 델피닌(delphinine)[135][138] |
스테로이드[139] 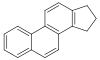 | 콜레스테롤, 아르기닌[140] | 솔라소딘(solasodine), 솔라니딘(solanidine), veralkamine[141] | |
성질

어미양이 익시아(Veratrum californicum)의 잎을 먹고 낳은 기형 새끼양. 이 식물에 들어있는 알칼로이드인 사이클로파민은 눈이 하나 밖에 없는 키클로푸스증을 유발할 수 있다.[142]
대부분 알칼로이드는 산소를 가지며 공기 중에서 무색 결정이 된다. 산소를 포함하지 않는 니코틴[143] 과 코닌[20] 은 대개 불안정하고 공기 중에서 무색의 기름 같은 액체로 된다.[144]베르베린과 상귀나린 같은 알칼로이드는 노란 계열의 색을 띠기도 한다.[144]
자연계의 분포
다양한 종류의 살아있는 생물체가 알칼로이드를 생산하며, 특히 관다발식물의 경우 10~25%의 종이 알칼로이드를 포함하고 있다.[145][146] 따라서 예전에는 "알칼로이드"라는 말이 식물과 묶여서 생각되었다.[147]
대개 식물에 포함된 알칼로이드는 몇 %이상을 넘지 않으며 당연히 조직 전반에 균질하지도 않다. 알칼로이드가 집중된 곳은 식물에 따라 잎(사리풀), 열매나 씨(스트리키니네), 뿌리(인도사목), 껍질(기나나무) 등으로 다르며,[148] 당연히 같은 식물이라도 조직에 따라 다른 알칼로이드를 포함할 수 있다.[149]
알칼로이드는 식물 뿐 아니라, 환각버섯속(Psilocybe)의 버섯종에서 얻는 실로시빈처럼 특정 균류에서도, 일부 두꺼비의 피부에 존재하는 독성 알칼로이드 부포테닌처럼 동물에서도 발견된다.[13] 해양 생물 역시 많은 것이 알칼로이드를 가지고 있다.[150]아드레날린이나 세로토닌 따위의 아민은 구조면이나 생합성 과정이 알칼로이드와 유사하며 고등생물에서 중요한 역할을 수행하는데, 이들을 알칼로이드라 부르기도 한다.[151]
같이 보기
- 아민
- 염기
- 천연물
- 2차 대사산물
각주
↑ Andreas Luch (2009). 《Molecular, clinical and environmental toxicology》. Springer. 20쪽. ISBN 3764383356.
↑ 가나 IUPAC. Compendium of Chemical Terminology, 2판. (The "Gold Book"). A. D. McNaught, A. Wilkinson 편집. Blackwell Scientific Publications, 옥스포드 (1997) ISBN 0-9678550-9-8 doi 10.1351/goldbook
↑ R. H. F. Manske. The Alkaloids. Chemistry and Physiology. Volume VIII. - 뉴욕: Academic Press, 1965, p. 673
↑ Robert Alan Lewis (1998). 《'Lewis' dictionary of toxicology'》. CRC Press. 51쪽. ISBN 1-56670-223-2.
↑ 가나다라 Chemical Encyclopedia: alkaloids
↑ Rhoades, David F (1979). 〈Evolution of Plant Chemical Defense against Herbivores〉. Rosenthal, Gerald A., and Janzen, Daniel H. 《Herbivores: Their Interaction with Secondary Plant Metabolites》. 뉴욕: Academic Press. 41쪽. ISBN 0-12-597180-X. CS1 관리 - 여러 이름 (링크)
↑ Robert A. Meyers Encyclopedia of Physical Science and Technology, 3판 중 Alkaloids 항목. ISBN 0-12-227411-3
↑ Leland J. Cseke, Natural Products from Plants. Second Edition. - CRC, 2006, p. 30 ISBN 0-8493-2976-0
↑ A. William Johnson. Invitation to Organic Chemistry, Jones and Bartlett, 1999, 433쪽 ISBN 0-7637-0432-6
↑ Raj K Bansal, A Text Book of Organic Chemistry. 4판, New Age International, 2004, 644쪽 ISBN 81-224-1459-1
↑ 가나다라 Aniszewski, 110쪽
↑ Hesse, 1~3쪽
↑ 가나 Hesse, 5쪽
↑ Hesse, 7쪽
↑ Aniszewski, 182쪽
↑ Hesse, 338쪽
↑ Hesse, 304쪽
↑ Hesse, 350쪽
↑ Hesse, 313~316쪽
↑ 가나 TSB: Coniine[깨진 링크(과거 내용 찾기)]
↑ Hesse, 204쪽
↑ 가나 Hesse, 11쪽
↑ Orekhov, 6쪽
↑ Aniszewski, 109쪽
↑ Dewick, 307쪽
↑ Hesse, 12쪽
↑ 가나 Plemenkov, 223쪽
↑ 가나 Hesse, 31쪽
↑ 가나다 Dewick, 381쪽
↑ 가나다라마바사아자 Dimitris C. Gournelif, Gregory G. Laskarisb and Robert Verpoorte (1997). “Cyclopeptide alkaloids”. 《Nat. Prod. Rep.》 14 (1): 75~82. PMID 9121730. doi:10.1039/NP9971400075.
↑ Aniszewski, 11쪽
↑ Plemenkov, 246쪽
↑ 가나 Aniszewski, 12쪽
↑ 가나 Dewick, 382쪽
↑ Hesse, 44, 53쪽
↑ 가나다 Plemenkov, 224쪽
↑ 가나다 Aniszewski, 75쪽
↑ Orekhov, 33쪽
↑ 가나다 Chemical Encyclopedia: Tropan alkaloids
↑ Hesse, 34쪽
↑ Aniszewski, 27쪽
↑ 가나다라 Chemical Encyclopedia: Pyrrolizidine alkaloids
↑ Plemenkov, 229쪽
↑ Blankenship JD, Houseknecht JB, Pal S, Bush LP, Grossman RB, Schardl CL (2005). “Biosynthetic precursors of fungal pyrrolizidines, the loline alkaloids”. 《Chembiochem》 6 (6): 1016~1022. PMID 15861432. doi:10.1002/cbic.200400327. CS1 관리 - 여러 이름 (링크)
↑ Faulkner JR, Hussaini SR, Blankenship JD, Pal S, Branan BM, Grossman RB, Schardl CL (2006). “On the sequence of bond formation in loline alkaloid biosynthesis”. 《Chembiochem》 7 (7): 1078~1088. PMID 16755627. doi:10.1002/cbic.200600066. CS1 관리 - 여러 이름 (링크)
↑ Schardl CL, Grossman RB, Nagabhyru P, Faulkner JR, Mallik UP (2007). “Loline alkaloids: currencies of mutualism”. 《Phytochemistry》 68 (7): 980–996. PMID 17346759. doi:10.1016/j.phytochem.2007.01.010. CS1 관리 - 여러 이름 (링크)
↑ Plemenkov, 225쪽
↑ Aniszewski, 95쪽
↑ Orekhov, 80쪽
↑ 가나다라마바 Chemical Encyclopedia: Quinolizidine alkaloids
↑ Saxton, 1권, 93쪽
↑ Aniszewski, 98쪽
↑ Saxton, 91쪽
↑ Joseph P. Michael (2002). “Indolizidine and quinolizidine alkaloids”. 《Nat. Prod. Rep》 19: 458~475. doi:10.1039/b208137g.
↑ Saxton, 1권, 92쪽
↑ Dewick, 310쪽
↑ Aniszewski, 96쪽
↑ Aniszewski, 97쪽
↑ 가나다 Plemenkov, 227쪽
↑ 가나 Chemical Encyclopedia: pyridine alkaloids
↑ 가나 Aniszewski, 107쪽
↑ 가나 Aniszewski, 85쪽
↑ Plemenkov, 228쪽
↑ 가나 Hesse, 36쪽
↑ 가나다라마바사아자차카타파하거너더러머버 Chemical Encyclopedia: isoquinoline alkaloids
↑ Aniszewski, 77~78쪽
↑ 가나다 Tadhg P. Begley.Encyclopedia of Chemical Biology: Alkaloid Biosynthesis
↑ 가나 Saxton, 3권, 122쪽
↑ 가나다 Hesse, p. 54
↑ 가나 Hesse, p. 37
↑ Hesse, p. 38
↑ 가나다 Hesse, p. 46
↑ 가나다 Hesse, p. 50
↑ 가나다 Kenneth W. Bentley (1997). “β-Phenylethylamines and the isoquinoline alkaloids”. 《Nat. Prod. Rep》 14 (4): 387–411. PMID 9281839. doi:10.1039/NP9971400387.
↑ 가나 Hesse, p. 47
↑ Hesse, p. 39
↑ 가나 Hesse, p. 41
↑ 가나 Hesse, p. 49
↑ Hesse, p. 44
↑ 가나다 Saxton, 3권, 164쪽
↑ 가나 Hesse, 51쪽
↑ 가나다 Plemenkov, 236쪽
↑ Saxton, 3권, 163쪽
↑ Saxton, 3권, 168쪽
↑ Hesse, 52쪽
↑ Hesse, 53쪽
↑ 가나다라마 Plemenkov, p. 241
↑ Arnold Brossi The Alkaloids: Chemistry and Pharmacology, Volume 35. - Academic Press, 1989, p. 261
↑ Arnold Brossi The Alkaloids: Chemistry and Pharmacology, Volume 35. - Academic Press, 1989, pp. 260–263
↑ 가나 Plemenkov, p. 242
↑ Tadhg P. Begley.Encyclopedia of Chemical Biology: Cofactor Biosynthesis
↑ John R. Lewis (2000). “Amaryllidaceae, muscarine, imidazole, oxazole, thiazole and peptide alkaloids, and other miscellaneous alkaloids”. 《Nat. Prod. Rep》 17 (1): 57–84. PMID 10714899. doi:10.1039/a809403i.
↑ Chemical Encyclopedia: Quinazoline alkaloids
↑ Aniszewski, p. 106
↑ 가나 Aniszewski, p. 105
↑ Richard B. Herbert; Herbert, Richard B.; Herbert, Richard B. (1999). “The biosynthesis of plant alkaloids and nitrogenous microbial metabolites”. 《Nat. Prod. Rep》 16: 199~208. doi:10.1039/a705734b.
↑ Plemenkov, pp. 231, 246
↑ Hesse, p. 58
↑ Plemenkov, p. 231
↑ 가나다라 Chemical Encyclopedia: Quinoline alkaloids
↑ 가나 Aniszewski, p. 114
↑ Orekhov, p. 205
↑ Hesse, p. 55
↑ 가나 Plemenkov, p. 232
↑ Orekhov, p. 212
↑ Aniszewski, p. 118
↑ 가나 Aniszewski, 112쪽
↑ 가나다라마바 Aniszewski, p. 113
↑ Hesse, 15쪽
↑ Saxton, 1권, 467쪽
↑ Dewick, p. 349-350
↑ 가나다 Aniszewski, p. 119
↑ Hesse, p. 29
↑ Hesse, pp. 23-26
↑ Saxton, 1권, 169쪽
↑ Saxton, 5권, 210쪽
↑ Hesse, pp. 17-18
↑ Dewick, p. 357
↑ 가나 Aniszewski, p. 104
↑ Hesse, p. 72
↑ Hesse, p. 73
↑ Dewick, p. 396
↑ “PlantCyc Pathway: ephedrine biosynthesis”. 2011년 12월 10일에 원본 문서에서 보존된 문서. 2010년 6월 6일에 확인함.
↑ Hesse, p. 76
↑ 가나 Chemical Encyclopedia: colchicine alkaloids
↑ Aniszewski, 77쪽
↑ 가나 Hesse, p. 81
↑ Arnold Brossi The Alkaloids: Chemistry and Pharmacology, Volume 23. - Academic Press, 1984, p. 376
↑ 가나 Hesse, p. 77
↑ Arnold Brossi The Alkaloids: Chemistry and Pharmacology, Volume 23. - Academic Press, 1984, p. 268
↑ Arnold Brossi The Alkaloids: Chemistry and Pharmacology, Volume 23. - Academic Press, 1984, p. 231
↑ 가나다라마바 Hesse, p. 82
↑ Spermine Biosynthesis
↑ 가나다라마바 Plemenkov, p. 243
↑ 가나다 Hesse, p. 84
↑ Chemical Encyclopedia: Terpenes
↑ Tadhg P. Begley.Encyclopedia of Chemical Biology: Natural Products: An Overview
↑ Atta-ur-Rahman and M. Iqbal Choudhary (1997). “Diterpenoid and steroidal alkaloids”. 《Nat. Prod. Rep》 14 (2): 191~203. PMID 9149410. doi:10.1039/np9971400191.
↑ Hesse, p. 88
↑ Dewick, p. 388
↑ Plemenkov, p. 247
↑ Cancer Drug Behind Cyclops Birth?, 와이어드 뉴스, 2006년 08월 14일
↑ “TSB: Nicotine”. 2012년 7월 22일에 원본 문서에서 보존된 문서. 2012년 2월 19일에 확인함.
↑ 가나 Grinkevich, p. 131
↑ Aniszewski, 13쪽
↑ Orekhov, 11쪽
↑ Hesse, p.4
↑ Grinkevich, 122~123쪽
↑ Orekhov, 12쪽
↑ Fattorusso, p. XVII
↑ Aniszewski, 110~111쪽
참고 문헌
- Tadeusz Aniszewski (2007). 《Alkaloids - secrets of life》(알칼로이드, 생명의 비밀) Amsterdam: Elsevier. ISBN 978-0-444-52736-3.
- Paul M Dewick (2002). 《Medicinal Natural Products. A Biosynthetic Approach》 Wiley. 제2판. ISBN 0-471-49640-5.
- Manfred Hesse (2002). 《Alkaloids: Nature's Curse or Blessing?》(알칼로이드: 자연의 저주? 아니면 축복?) Wiley-VCH. ISBN 978-3-906390-24-6.
- Orekhov AP (1955). 《Chemistry alkaloids》(알칼로이드 화학) Acad. 제2판. M.: USSR.
- Plemenkov VV (2001). 《Introduction to the Chemistry of Natural Compounds》(천연화합물 화학 개론) Kazan.
- J. E. Saxton (1973). 《The Alkaloids. A Specialist Periodical Report》 - 런던: The Chemical Society.
분류:
- 알칼로이드
(RLQ=window.RLQ||[]).push(function()mw.config.set("wgPageParseReport":"limitreport":"cputime":"0.752","walltime":"0.904","ppvisitednodes":"value":5325,"limit":1000000,"ppgeneratednodes":"value":0,"limit":1500000,"postexpandincludesize":"value":53424,"limit":2097152,"templateargumentsize":"value":3765,"limit":2097152,"expansiondepth":"value":15,"limit":40,"expensivefunctioncount":"value":0,"limit":500,"unstrip-depth":"value":0,"limit":20,"unstrip-size":"value":76472,"limit":5000000,"entityaccesscount":"value":1,"limit":400,"timingprofile":["100.00% 627.084 1 -total"," 13.47% 84.455 8 틀:ISBN"," 11.27% 70.650 9 틀:저널_인용"," 10.54% 66.094 3 틀:서적_인용"," 9.69% 60.779 1 틀:전거_통제"," 4.69% 29.422 8 틀:Catalog_lookup_link"," 4.50% 28.207 1 틀:Llang"," 3.90% 24.469 1 틀:알칼로이드"," 3.73% 23.407 8 틀:Error-small"," 3.40% 21.318 1 틀:둘러보기_상자"],"scribunto":"limitreport-timeusage":"value":"0.160","limit":"10.000","limitreport-memusage":"value":3994369,"limit":52428800,"cachereport":"origin":"mw1330","timestamp":"20190712130555","ttl":2592000,"transientcontent":false););"@context":"https://schema.org","@type":"Article","name":"uc54cuce7cub85cuc774ub4dc","url":"https://ko.wikipedia.org/wiki/%EC%95%8C%EC%B9%BC%EB%A1%9C%EC%9D%B4%EB%93%9C","sameAs":"http://www.wikidata.org/entity/Q70702","mainEntity":"http://www.wikidata.org/entity/Q70702","author":"@type":"Organization","name":"uc704ud0a4ubbf8ub514uc5b4 ud504ub85cuc81dud2b8 uae30uc5ecuc790","publisher":"@type":"Organization","name":"Wikimedia Foundation, Inc.","logo":"@type":"ImageObject","url":"https://www.wikimedia.org/static/images/wmf-hor-googpub.png","datePublished":"2010-12-07T12:08:24Z","dateModified":"2019-05-11T03:36:23Z","image":"https://upload.wikimedia.org/wikipedia/commons/d/d6/Papaver_somniferum_01.jpg"(RLQ=window.RLQ||[]).push(function()mw.config.set("wgBackendResponseTime":140,"wgHostname":"mw1247"););